Kumulativne travmatske motnje
Kumulativne travmatske motnje lahko nastanejo zaradi statičnih skrajnih fleksijskih položajev, ki so kvarni za ledveni del. Kažejo se s pojavom neprijetnih občutkov, bolečine, otrdelosti z omejeno gibljivostjo sklepov in oslabelosti v smislu trenutne nesposobnosti generiranja sil oz. prenašanja obremenitev v okviru fizioloških sposobnosti (LaBry in sod, 2004).
Najpogostejši kvarni mehanizem za tkiva v ledvenem delu hrbtenice je skrajno končni fleksijski položaj. Do tega pride lahko ali pri dolgotrajnemu zadrževanju v predklonu ali pri kifotičnem sedenju (Iqbal in Alghadir, 2017; Putz-Anderson, 1988). Raziskave so bile izvedene na živalih in ljudeh. Raziskave na ljudeh so bile metodološko izvedene v različnih skrajnih položajih fleksije: v skrajno fleksijskem sedečem položaju, (McGill in Brown, 1992; Solomonow in sod. 2003c; Granata in sod., 2005; Dolan in sod., 2005; Hatipkarasulu s sod, 2006; Rogers in Granata, 2006; Shin in Mirka, 2007; Hashemirad, 2010; Sánchez-Zuriaga in sod., 2010; Hendershot in sod. 2011;Toosizadeh in sod. 2012; Abboud in sod. 2016; Abboud in sod. 2018a; Abboud in sod. 2018b) ali v stoje s predklonom (Shin in sod. 2009; Bazrgari in sod., 2011; Muslim in sod., 2013; Toosizadeh in Nussbaum, 2013). To so položaji v katerih se ljudje hitro zadržujejo dalj časa. Npr. sedeče delo z računalnikom ali vrtnarjenje.
Uvod
Twomey in Taylor sta bila začetnika, ki sta na mrličih raziskovala posledice skrajnih in dolgotrajnih fleksijskih položajev hrbtenice. Viskoelastična tkiva* hrbtenice sta natezno obremenila in opazovala fenomen lezenja. Zanimalo ju je odzivanje viskoelastičnih tkiv na različno velike in različno dolge obremenitve. Ugotovila sta, da se pri skrajnem fleksijem položaju ledvenega dela količina lezenja tkiva povečuje z velikostjo obremenitvije in z daljšanjem časa (Twomey in Taylor, 1982).
Viskoelastičnost
Značilnost vezivnega tkiva je *viskoelastičnost. Viskoelastičnost je način odzivanja tkiva na zunanjo deformacijo (Sanchez-Zuriaga in sod., 2010). Woo je s sodelavci raziskoval odzivanje ligamentov na natezno obremenitev. Kot odgovor na natezno obremenitev je najprej tako imenovano začetno območje. To je območje pri katerem pride do precejšnje deformacije že pri manjših silah. Tu se pri normalnih pogojih izvaja največ dnevnih, funkcionalnih aktivnosti. Kolagenska vlakna so sproščena in valovita.
Kadar se obremenitev stopnjuje, tkivo preide v elastično deformacijo. Elastično območje je območje ob koncu obsega gibljivosti, ko se začne tkivo upirati določeni sili. Pri tem pride sprva do izravnave kolagenskih vlaken. Najprej se odvijejo vijačnice kolagenskih vlaken z bolj zavito vijačnico. Ob povečevanju obremenitve pa se odvijejo še manj zavite vijačnice kolagena. Pride lahko do mikro poškodb kolagenskih vlaken in do iztisa vode iz matriksa.
Ko sila preneha delovati, se je tkivo sposobno vrniti v izhodiščni položaj. Obstaja pa meja med tem, ko se tkivo povrne v izhodiščni položaj in med trajno, plastično deformacijo tkiva. Meja elastičnosti je točka pri kateri se tkivo ni več sposobno vrniti v izhodiščni položaj. Območje plastičnosti se razteza med elastično mejo in rupturo tkiva. Tkivo je v območju plastične deformacije trajno spremenjeno in se ni več sposobno vrniti v izhodiščni položaj. Pride do okvare velikega števila kolagenskih vlaken in do makro poškodb kolagenskih vlaken (Woo in sod., 2000).
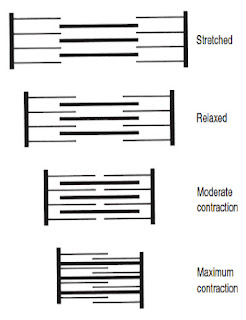
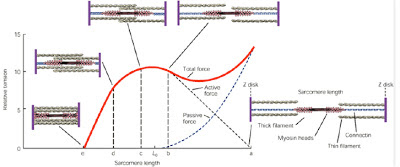
Kadar na tkivo z viskoelastičnimi lastnostmi dovolj dolgo deluje stalna obremenitev, se tkivo sčasoma podaljšuje. Podaljševanje poteka eksponentno, dokler tkivo ne doseže svojega maksimuma. Ta proces podaljševanja imenujemo lezenje. Lezenje je odvisno od viskoelastičnih lastnosti tkiva. Velikost deformacije je odvisna od časa in velikosti obremenitve (Twomey in Taylor, 1982).
Na velikost deformacije pa vpliva tudi rezidualno lezenje – to je lezenje oz. deformacija, ki je ostala od predhodnjih obremenitev in se ni uspela še popolnoma regenerirati. Za regeneracijo tkiva, ki je bilo izpostavljeno samo 20 minut maksimalnemu fleksijskemu položaju, ni zadoščalo 7 ur (Solomonow in sod. 2003). Avtorji ocenjujejo, da je za popolno regeneracijo potrebnih od 24 ali celo 48 ur (Solomonow, 2012).
Patofiziologija
Ligamenti
V skrajnem fleksijskem položaju se raztegnejo posteriorno ležeče strukture. Solomonowa raziskovalna skupina je naredila serijo raziskav na supraspinalnih ligamentih mačk. Supraspinalne ligamente so različno dolgo natezno obremenjevali, v različnih razmerjih med odmorom in obremenitvijo in različno velikimi obremenitvami. Z EMGjem so merili refleksno aktivnost multifidov in nestabilnost zaradi disfunkcije živčno-mišičnega sistema ter ohlapnosti ligamentov zaradi raztegnjenosti.
Supraspinalni ligamenti so se po prenehanju natezne obremenitve v prvi uri regenerirali nekje od 40-60 %, odvisno od velikosti obremenitve, ki so jim bili izpostavljeni. Za popolno regeneracijo pa je potrebno daljše časovno obdobje – ocenjujejo nekje od 24 ali celo 48 ur pri večjih obremenitvah. Kakor se ligamentu vrača njegova prvotna dolžina, tako se popravlja tudi odzivnost refleksov in normalizira tonus paraspinalnih mišic. Kadar pa so supraspinalni ligamenti ciklično obremenjeni in je med obremenitvami premalo odmora za regeneracijo, lahko pride do KTM, degradacije tkiv in strukturnih okvar ligamentov (Solomonow, 2009; Le in sod. 2009).
Dolgotrajni razteg spinalnih ligamentov, do katerega pride pri skrajnemu fleksijskemu položaju, namreč zmanjša vzdražnost mehanoreceptorjev, kar posledično povzroči zmanjšan odziv mišic (Solomonow in sod., 1999…..). Sanchez-Zuriaga in sod. (2010) so potrdili skladno s Solomonovo raziskavo (2003c), da pri lezenju pride do povečane latence refleksov, kar pomeni kasnejšo odzivnost refleksov (za razliko od tega, da pri utrujenosti živčno-mišičnega kompleksa ne pride do povečane latence refleksov) (Sanchez- Zuriaga in sod., 2010).
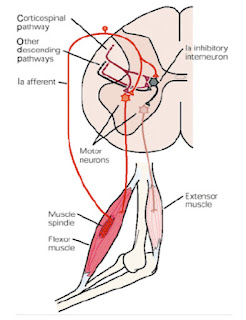
Refleksna aktivnost, do katere pride zaradi vzdraženja mehanoreceptorjev tipa I. in III. v ligamentih, je namenjena zagotavljanju stabilnosti sklepa. Refleksno se lahko facilitira ali inhibira tonus mišic, ki prečkajo sklep (direkten vpliv na stabilnost sklepa) in mišic, ki ne prečkajo sklepa (indirekten vpliv na stabilnost sklepov) (Solomonow 2009). Dolgotrajna natezna obremenitev spinalnih ligamentov pa povzroči spremenjeno delovanje živčno-mišičnega sistema.
V obdobju natezne obremenitve pride do posameznih, naključnih spazmov v multifidih. V obdobju po natezni obremenitvi pa se pojavi začasna inhibicija tonusa (Solomonow in sod. 2003a; Solomonow in sod. 2003b; Sbriccoli in sod. 2004; LaBry in sod. 2004). Odvisno od velikosti obremenitve (pri nizki obremenitvi se pojavi 3 do 4 ure, pri visoki pa takoj ali v prvi uri po obremenitvi) pa se pojavi facilitacija tonusa multifidov (Le in sod. 2009).
V obdobju po obremenitvi je torej inhibicija tonusa mišic, ki stabilizirajo hrbtenico, nestabilnost hrbtenice in velika nevarnost poškodb (Le in sod, 2009). Poleg disfunkcije živčno-mišičnega sistema (do katere pride že po 2 minutah natezne obremenitve) pa se v ligamentih razvije še fenomen lezenja, kadar natezna obremenitev traja dalj časa – že po 10 minutah. Ligament postane ohlapen in sam po sebi ne zmore več zagotavljati stabilnosti sklepa.
Torej je v obdobju po obremenitvi hrbtenica izpostavljena poškodbam zaradi dveh kvarnih mehanizmov: disfunkcije živčno-mišičnega sistema in inhibicije tonusa mišic, ki bi zagotavljale stabilnost hrbtenice, in podaljšanja ter posledično ohlapnosti ligamentov, ki bi zagotavljali stabilnost hrbtenice.
Refleksna aktivnost
Posledica lezenja v viskoelastičnih vezivnih tkivih je tudi nepravilno delovanje refleksnega sistema, ki uravnava mišični tonus in omogoča stabilnost hrbtenice. Sistem za zagotavljanje gibljivosti in stabilnosti hrbtenice je odvisen tudi od impulzov, ki jih dobi iz različnih mehanoreceptorjev na periferiji. Impulzi se iz mehanoreceptorjev preko aferentnih vlaken prenesejo v višje možganske centre, odgovor pa nato po eferentnih vlaknih nazaj do periferije.
Ko se sklepni, kožni in mišična mehanoreceptorja aktivirata, se sproži refleksna aktivnost, ki skupaj z vplivom višjih možganskih centrov, nato uravnavajo mišični tonus. Pri tem lahko pride do inhibicije ali facilitacije mišičnega tonusa. Mišice se s tem aktivirajo v pravilnem zaporedju in jakosti, da se omogoča oziroma omeji gibanje hrbtenice in doseže stabilnost določenih delov hrbtenice (Solomonow, 2009; Solomonow, 2012). Kadar se v tkivu pojavi fenomen lezenja, refleksni sistem deluje drugače. Posledica spremenjenega delovanja zaradi lezenja je nestabilnost hrbtenice in večja verjetnost za nastanek poškodb (Twomey in Taylor, 1982; Abboud, 2018).
V ligamentih so mehanoreceptorji I. in III., ki skupaj z ostalimi mehanoreceptorji dovajajo proprioceptivne informacije CŽS. Mehanoreceptorji tipa III so občutljivi na razteg. Ko se ligament raztegne, se mehanoreceptorji vzdražijo. Impulz se prenese po živčnih vlaknih do CŽS, ki refleksno inhibira delovanje določenih mišic. Dolgotrajni razteg lahko poškoduje ligamente, okvari mehanoreceptorje in/ali spremenil vzdražnostni prag mehanoreceptorjev. Proprioceptivna informacija iz periferije je spremenjena.
Posledično pride zato do drugačne mišične aktivacije in spremenjene znotraj-mišične in med-mišične koordinacije (Solomonow 2009; Purkart, 2019). 20-minutni maksimalni fleksijski položaj v tkivih ledvenega dela hrbtenice človeka in živali povzroči lezenje (McGill in Brown, 1992; Solomonow in sod., 2003a). Po obremenitvi, ki je povzročila mikro poškodbe ligamentov, se pojavi nepravilno delovanje živčno-mišičnega sistema. V 1 uri po 20-minutni natezni obremenitvi se pojavi povečana odzivnost refleksov. Ta povečana odzivnost refleksov traja nekje od 2 do 6 ur v fazi počitka – torej ko ni več natezne obremenitve.
Ker je povečana odzivnost refleksov povezana z vnetnimi procesi v obremenjenih tkivih, je povečana odzivnost refleksov prehodna in se postopno zmanjšuje, tako kot se okvarjena tkiva celijo oz. kot se zmanjšuje vnetje (Solomonow in sod., 2003 a). Tudi po 3-kratni 10-minutni natezni obremenitvi, ki je imela vmes 10-minutni odmor se je pojavila povečana odzivnost refleksov, v celotnem, 7-urnem obdobju v fazi počitka (Solomonow in sod., 2003 b).
Problem lahko nastane, kadar se natezne obremenitve ponavljajo. Torej že enkratno 20-minutno ali večkratno 10-minutno zadrževanje v skrajnem fleksijskem položaju povzroča akutno vnetje. Akutno vnetje viskoelastičnih tkiv v hrbtenici potrebuje kar precej časa, da se zaceli. In če telo nima ustreznega časa za regeneracijo, akutno preide v kronično vnetje. Kronično vnetje pa povzroči degradacijo tkiv in zmanjšanje prenašanja mehanskih obremenitev (Solomonow in sod., 2003 b; LaBry….; Solomonow in sod., 2012; Solomonow, 2012).
Fasetni sklepi
Poleg spinalnih ligamentov se v skrajnih fleksijskih položajih raztegnejo posteriorna vlakna fibrozne membrane sklepne kapsule fasetnih sklepov. Fibrozna membrana vsebuje mehanoreceptorje tipa I. in II. Draženje teh mehanoreceptorjev povzroči refleksno inhibicijo mišičnega tonusa. Poleg tega sodelujejo tudi pri toničnemu mišičnemu tonusu – torej pri odzivnosti refleksov (Purkart, 2019). Poleg tega se verjetno vzdražijo tudi mehanoreceptorji v koži. Nismo zasledili nobene raziskave, ki bi se izolirano osredotočila na vpliv raztega vezivnih vlaken v koži ali v posteriornih vlaknih fasetnih sklepov pri dolgotrajnih fleksijskih položajih hrbtenice in kakšen vpliv imajo na mišični tonus.
Glede na to, da so sklepni in mišični mehanoreceptorji med seboj povezani v funkcionalne enote (Van der Wal, 2009) bi lahko predpostavljali, da verjetno tudi kožni mehanoreceptorji sodelujejo pri refleksni aktivnosti mišic in delujejo skupaj s sklepnimi mehanoreceptorji. Po drugi strani pa se moramo zavedati, da so vezivna vlakna v koži precej mrežasto razvejana v vse smeri in da je število vlaken, ki se raztegne v koži zato zelo majhno in verjetno zato tudi majhen vpliv na skupni priliv vseh informacij iz periferije v hrbtenjačo.
Torakolumbalna fascija
Pri končnem fleksijskem položaju – še posebej če je flektirana tudi torakalna hrbtenica, se raztegne tudi torakolumbalna fascija. Torakolumbalna fascija je iz vezivnih vlaken, zato natezna obremenitev povzroči, da se tudi v fasciji po določenem času razvije fenomen lezenja. Kakšen je njen vpliv v celotni proprioceptivni informaciji še ni znano. Najverjetneje informacije iz intersticijskih mehanoreceptorjev v torakolumbalni fasciji sodelujejo pri oblikovanju proprioceptivne informacije, ki jo dobi CŽS in vplivajo na znotraj-mišično in med-mišično koordinacijo.
Medvretenčna ploščica
Naslednje tkivo, ki je podvrženo fenomenu lezenja zaradi zadrževanja v skrajnem fleksijskem položaju je medvretenčna ploščica. Po nekaterih hipotezah je okvara medvretnčne ploščice najbolj pogost razlog za bolečine v ledvenem delu (Petit in Roquelaure, 2015).
Najbolj kvarni položaj za medvretenčno ploščico je fleksija oziroma fleksija z rotacijo (Adams, 2010). Vsekakor lahko centralne rupture, ki nastajajo v anulusu medvretenčne ploščice zaradi nepravilnih obremenitev na eni strani in staranja na drugi strani oziroma nesposobnosti anulus, da se ustrezno prrilagodi večjim obremenitvam (kot npr. ligamenti in mišice) zaradi praktično odsotnosti žilja in posledično močno omejene kapacitete regeneracije. Dolgotrajni fleksijski položaj povzroči pritisk na tekočino v posteriornem nukleusu. Tekočina je nestisljiva, zato se nukleus premakne posteriorno in pritisne na lamele posteriornega dela anulusa (Adams, 2010).
Mišični tonus
Motorični nevron, ki regulira mišični tonus paraspinalnih mišic, dobiva aferentne impulze iz mehanoreceptorjev v koži, sklepni kapsuli, ligamentih, anulusu, ki lahko facilitirajo ali inhibirajo mišični tonus. »Seštevek in odštevek« vseh prilivov pa regulira mišični tonus (Purkart, 2019). Solomonowe raziskovalna skupina je pokazala, da dolgotrajajoč fleksijski položaj povzroči mikro rupture viskoelastičnih tkiv ledvenega dela, med katerimi je tudi anulus.
Refleksno pride do disfunkcije živčno-mišičnega sistema. Najprej je mišični tonus paraspinalnih mišic inhibiran, kasneje pa pride do facilitacije tonusa, zaradi poškodbe natezno obremenjenih viskoelastičnih tkiv. Ko tkiva postopno okrevajo po poškodbi, se tonus počasi normalizira. Nizke dolgotrajajoče obremenitve povzročajo blago vnetje in relativno hitro okrevanje v primerjavi z visokimi obremenitvami. S protektorno povišanim mišičnim tonusom poskuša telo zaščiti poškodovano območje pred nadaljnimi poškodbami in omogočiti celjenje poškodovanega področja (Solomonow, 2003a).
Kadar pa telo nima dovolj časa za regeneracijo, pride do KTM, degradacije tkiva in strukturnih sprememb medvretenčne ploščice ter spremenjenega občutka za kinestetični položaj, kinestetike, znotraj-mišične in med-mišične koordinacije (Solomonow, 2003a;Sbricolli in sod., 2004; Solomonow, 2009; Solomonow, 2012).
Mišica
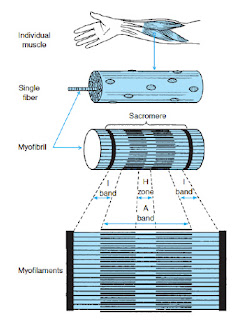
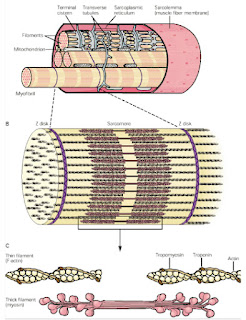
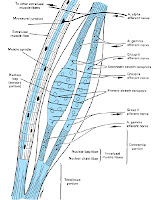
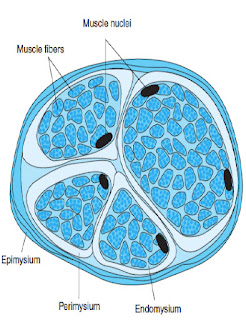
Mišica je zgrajena iz mišičnega in vezivnega tkiva, ki skupaj delujeta kot celota. Vezivno tkivo daje oporo mišičnemu tkivu. Mišično tkivo pa omogoča, da se mišica krči. Več mišičnih vlaken je združenih v snopič, ki je obdan z vezivno-tkivno ovojnico. Več snopičev se povezuje v snop, ki je obdan z vezivno-tkivno ovojnico. Vsi snopi pa so obdani z zunanjo mišično ovojnico.
Vezivna tkiva v mišicah imajo enake lastnosti kot vezivna tkiva v ligamentih in sklepnih kapsulah. Dolgo časa je veljalo, da zunanje mišične ovojnice, t.i. fascije, nimajo pomembne vloge pri gibanju. Novejše raziskave pa odkrivajo, da se tudi v fascijah nahajajo mehanoreceptorji. Poimenovali so jih intersticijski mehanoreceptorji, ki so občutljivi na razteg. Povezani naj bi bili z avtonomnim živčnim sistemom. To odpira novo poglavje sinergističnega delovanja mišičnega in vezivnega tkiva v mišici ter morebitno vlogo pri oblikovanju proprioceptivne informacije (Schleip, 2003; Schleip, 2017).
Hipoteza pepelke
Nekateri avtorji zagovarjajo hipotezo, da bolečine pri kumulativnih motnjah, izhajajo iz preobremenitve določenih mišic. Haag je to poimenoval hipoteza pepelke. Ime je nadel po Pepelki, pravljični junakinji, ki je prva vstajala in šla zadnja spat (Haag, 1988). Mišična vlakna se večinoma aktivirajo po Hennemanovem principu*. To naj bi veljalo tudi za mišična vlakna tipa I.
Hennemanov princip pravi, da se pri nizko intenzivnih obremenitvah aktivirajo mišična vlakna tipa I prva in se zadnja deaktivirajo. Torej naj bi bila stalno aktivna in kljub temu, da imajo dobro vzdržljivost, naj bi prišlo do preobremenitve. Posledica stalne aktivacije teh vlaken naj bi sprožila procese degradacije in razgradnjo mišičnih vlaken (Kadefors in sod. 1999). Poškodovana mišična vlakna naj bi ostala še nekaj časa v mišici in motila procese celjenja.
Zagovorniki Pepelkine hipoteze pravijo, da stalna nizko intenzivna obremenitev počasnih motoričnih enot (to so mišična vlakna tipa I. s pripadajočim motoričnim nevronom) kot je npr. dolgotrajni fleksijski položaj, okvari živčno-mišični stik in povzroči energetsko krizo. Energetska kriza je posledica na eni strani povečane potrebe po energiji (zaradi nenehne kontrakcije mišičnega vlakna) in na drugi strani otežkočene dostave hranil (kontrakcija mišičnih vlaken stisne krvne žile in otežkoča pretok po njih).
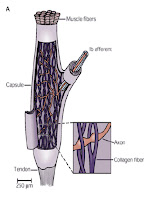
Mišično prožilne točke lahko nastanejo v trebuhu mišice ali na prehodu tetive v mišico (Simons in sod., 1999). Mesta, kjer nastanejo stalno kontrahirana vlakna sovpada z mesti, kjer ležita oba mišična mehanoreceptorja. Mišična vretena se nahajajo na sredini trebuha mišice, Golgijev tetivni organ pa na prehodu tetive v mišico. Predvidevamo, da to ni naključje in da sta oba mehanoreceptorja vključena v patofiziologijo nastanka mišično prožilnih točk.
Hennemanov princip
Henneman je že davnega leta 1965 odkril, da obstaja vrstni red aktivacije živčnih vlaken in seveda posledično mišičnih vlaken. Zakon je poimenoval Hennemanov princip velikosti*. Hennemanov princip velikosti pravi, da se živčna vlakna aktivirajo od tanjših proti debelim. To pomeni, da se vedno najprej aktivirajo počasna mišična vlakna (tip I), ki lahko razvijejo majhne sile, ampak se počasi utrudijo in se šele kasneje aktivirajo (če je potreba po večji sili) hitra mišična vlakna (tip II), ki lahko razvijejo velike sile, vendar se hitro utrudijo. Ravno obratno pa je pri deaktivaciji. Najprej se deaktivirajo hitra mišična vlakna (tip II) in nazadnje počasna mišična vlakna (tip I) (Henneman in sod., 1965).
Fenomen lezenja
Ko se posteriorno ležeča tkiva raztegnejo med kratkotrajno – že samo 5 sekund trajajočo skrajno fleksijo ledvene hrbtenice, se v viskoelastičnih tkivih v posteriornih spinalnih ligamentih, posteriornem delu sklepne kapsule, torakolumbalni fasciji (če je flektiran tudi torakalni del), posteriornem delu anulusa medvretenčne ploščice, vzdražijo mehanoreceptorji. Impulzi po aferentih vlaknih povzročijo refleksno inhibicijo mišičnega tonusa paraspinalnih mišic (Solomonow, 2012).
Ta refleksna inhibicija mišičnega tonusa, do katere pride zaradi raztega vezivnih tkiv med fleksijskim položajem hrbtenice, so poimenovali fleksijsko-relaksacijski fenomen. Pojavi se v skrajnem fleksijskem položaju tako v stoje kot tudi pri sedenju. Rezultati študij kažejo na to, da obstajajo različni motorični vzorci, najverjetneje zaradi različnih metodoloških napotkov preiskovancem (kako naj se kifotično usedejo). Vsekakor pa raziskave kažejo na to, da že nekaj sekund kifotičnega sedenja v skrajnih fleksijskih ali pa celo v srednjih položajih ledvenega dela med sedenjem, povzročijo inhibicijo mišičnega tonusa v določenih paraspinalnih mišicah (O’Sullivan in sod, 2006; Callaghan in Dunk, 2002).
Metodološki problem EMG raziskav s površinskimi elektrodami še vedno ostaja in to je žal dostopnost samo do površinskih multifidov in nedostopnost do globokih multifidov, ki dejansko stabilizirajo hrbtenico (zato so raziskave na živalih dobrodošle, saj nam lahko podajo razumevanje o dogajanju globokih multifidov, ki dejansko stablizirajo hrbtenico).
Poudariti pa želimo to, da do inhibicije mišičnega tonusa pride ne zaradi lezenja vezivnih tkiv, saj se fleksijsko-relaksacisjski fenomen pojavi že v parih sekundah kifotičnega sedenja. Najverjetneje je vzrok za inhibicijo mišičnega tonusa paraspinalnih mišic med kifotičnim sedenjem vzdraženje mehanoreceptorjev, ki se nahajajo v vezivnih tkivih sklepne kapsule fasetnih sklepov (mehanoreceptorji tipa I in II), spinalnih ligamentih (mehanoreceptorji tipa III) in anulusu ter morda torakolumbalni fasciji (intersticijski mehanoreceptorji).
Slaba drža
Rezultati raziskav potrjujejo, da že 10 minutno zadrževanje v skrajnem fleksijskem položaju hrbtenice, kar je pogosto pri kifotičnemu sedenju (npr. med delom z računalnikom) ali pri opravljanju različnih opravil v sklonjenem stoječem položaju (npr. vrtnarjenje), povzroči fenomen lezenja v raztegnjenih viskoelastičnih tkivih hrbtenice in disfunkcijo živčno-mišičnega sistema.
Čas popolne regeneracije viskoelastičnih tkiv, ki so bila samo enkrat izpostavljeno daljši natezni obremenitvi (npr. 20 min), pa ocenjujejo na nekje od 24 do 48 ur, morda celo več pri večji oz. daljši obremenitvi. Že med samo obremenitvijo nastajajo posamezni spazmi, ki že nakazujejo na posamezne mikro rupture v tkivih. Takoj po obremenitvi je za kratek čas facilitiran tonus paraspinalnih mišic, nato pa sledi krajše obdobje inhibicije mišičnega tonusa.
V tem obdobju je hrbtenica nestabilna (na eni strani zaradi ohlapnosti vezivnih tkiv in na drugi strani zaradi inhibicije tonusa) in ranljiva za poškodbe. Odvisno od velikosti obremenitve sledi obdobje facilitacije tonusa. Večje obremenitve povzročijo hitrejšo in večjo refleksno facilitacijo tonusa, medtem ko manjše obremenitve povzročijo kasnejšo in manjšo refleksno facilitacijo tonusa. In ravno v tem obdobju, je največja verjetnost nastanka poškodb.
Npr. po 30-minutnem kifotičnem sedenju se ustanemo s stola. Začutimo rahlo zategnjenost v ledvenem delu, ki je posledica trenutno facilitiranega tonusa paraspinalnih mišic. Malo počakamo, da ta občutek popusti, nato se predklonimo naprej, da poberemo svinčnik iz tal. Obstaja velika verjetnost, da bo prišlo do zdrsa medvretenčne ploščice zaradi refleksne inhibicije tonusa multifidov, ki stabilizirajo hrbtenico.
Zaključek in ergonomski napotki
- Ozaveščajmo ljudi, da vsi spremenimo navade in se povsem izogibamo opravljanju dela ali drugih domačih opravil v stoječem položaju sklonjeni naprej; hrbtenica naj ne bo upognjena do skrajnega, končnega položaja, ampak naj bo bolj »ravna«, tako da so fasetni in intervertebralni sklepi bolj v srednjem položaju; kolena naj bodo pokrčena, da se izognemo poškodbam zaradi fenoma lezenja v posteriornem delu spodnjih okončin.
- Izogibajmo se dvigovanju bremen iz sklonjenega položaja oz. razdelimo breme na manjša bremena in ga dvigujemo z bolj »ravnim« hrbtom.
- Če se ne da izogniti sklanjanju s skrajno upognjeno hrbtenico, poskrbimo da kvarna obremenitev traja čim manj časa in jo raje časovno razdelimo na več krajših obremenitev.
- Med obremenitvami v statičnih sklonjenih položajih naj bo dovolj časa za regeneracijo; čas regeneracije mora biti bistveno daljši kot je obdobje obremenjevanja; pogosto to zaradi dolgega obdobja za popolno regeneracijo (študije na živalih kažejo, da je 7 ur premalo za regeneracijo, popolna regeneracija traja morda celo 24 ur, 48 ur ali več) ni praktično izvedljivo, zato je boljše izogibanje skrajnim, končnim položajem upogibanja hrbtenice.
- Razmerje med odmorom in obremenitvijo naj bo vsaj 1:1 (če trajajo obremenitve do 10 min) ali raje več v korist odmora.
- Vsekakor pripomore k raznolikosti položajev in izogibanju kumulativnih travmatskih motenj v tkivih tudi rotacija delavcev (ki opravljajo določene delovne naloge v sklonjenem stoječem položaju) na različne delovne položaje v roku istega dneva in v obdobju delovnega tedna; na ta način se lahko omogoči daljše obdobje razbremenjevanja in omogoča regeneracije tkiv, ki so bila obremenjena v predhodnjem ciklu.
- Ne izvajamo razteznih vaj, pri katerih je hrbtenica v skrajnem končnem položaju – npr. stoje in dotik prstov s tlemi. Vaja ni ustrezna, saj povzroča fenomen lezenja in okvaro v posteriornih tkivih hrbtenice že po 2 minutah. Za raztezanje mišic zadnjega dela spodnjih okončin v stoje, naj se izvaja vaja z iztegnjenimi koleni in upogibom v kolčnem sklepu ter povsem »ravnim« hrbtom.
- Ergonomski stoli in ozaveščanje za pokončno sedenje
- Premikajoče mize, ki omogočajo delo za računalnikom v sedečem ali stoječem položaju
- Vsakih 15 minut naj se vstane in »pretegne« hrbtenico ter dvigne roke
- Če se zadržujemo nekaj časa v kvarnem položaju, bodimo potem nekaj ur zelo previdni in se zavedajmo, da je to naša hrbtenica v tem obdobju ranljiva za poškodbe.
Literatura
- Abboud, J., Nougarou, F., Descarreaux, M. (2016). Muscle activity adaptations to spinal tissue creep in the presence of muscle fatigue. Plos One.
- Abboud, J., Rousseau, B., Descarreaux, M. (2018). Trunk proprioception adaptations to creep deformation. European journal of applied physiology, str. 133-142.
- Adams, M., Dolan, P. (1996). Time dependent changes in lumbar spine resistance to bending. Clinical Biomechanics, str. 194–200.
- Bazrgari, B., Hendershot, B., Muslim, K., Toosizadeh, N., Nussbaum, M. A., Madigan, M. L. (2011). Disturbance and recovery of trunk mechanical and neuromuscular behaviours following prolonged trunk flexion: influences of duration and external load on creep-induced effects. Ergonomics, str. 1043-1052.
- Callaghan JP, Dunk NM. (2002). Examination of flexion relaxation phenomenon in erector spinae muscles during short duration slump position. Clin Biomech (Bristol, Avon) 17:353–60
- Granata, K. P., Rogers, E. in Moorhouse, K. (2005). Effects of Static Flexion-relaxation on Paraspinal Reflex Behavior. Clinical biomechanics, 20(1), 16-24.
- Hagg, G. M. (1988). New explanation for muscle damage as a result of static loads in the neck and shoulder. Arbete Manniska Miljo, str. 260-262.
- Hashemirad, F., Talebian, S., Olyaei, G. R., Hatef, B. (2010). Compensatory behaviour of the postural control system to flexion-relaxation phenomena. Journal of bodywork and movement therapies, str. 418-423.
- Hatipkarasulu, G. S., Aghazadeh, F., Nimbarte, A. D. (2011). Loading and recovery behaviour of the human lumbar spine under static flexion. Work, str. 111-122.
- Hatipkarasulu, G. S., Aghazadeh, F., Nimbarte, A. D. (2011). Loading and recovery behaviour of the human lumbar spine under static flexion. Work, str. 111-122.
- Hendershot, B., Bazrgari, B., Muslim, K., Toosizadeh, N., Nussbaum, M. A., Madigan, M. L. (2011). Disturbance and recovery of trunk stiffness and reflexive muscle responses following prolonged trunk flexion: influences of flexion angle and duration. Clinical Biomechanics, str. 250-256.
- Henneman, E. Somjen, G., Carpenter, D. O. (1965). Functional significance of cell size in spinal moto-neurons. Journal of neurophysiology, str. 560-580.
- Iqbal, Z. A., Alghadir, A. H. (2017). Cumulative trauma disorders: A review. Journal of back and musculoskeletal rehabilitation, str. 663-666.
- Kadefors R1, Forsman M, Zoéga B, Herberts P. (1999) Recruitment of low threshold motor-units in the trapezius muscle in different static arm positions. Ergonomics, 42(2):359-75.
- LaBry, R., Sbriccoli, P., Zhou, B., Solomonow, M. (2004). Longer static flexion duration elicits a neuromuscular disorder in the lumbar spine. Journal of applied kinesiology, str. 2005-2015.
- Le, B., Davidson, B., Solomonow, D., Zhou, B. H., Lu, Y., Patel, V., Solomonow, M. (2009). Neuromuscular control of lumbar instability following static work of various loads. Muscle and Nerve, str. 71-82.
- McGill, S.M. Brown, S. (1992). Creep response of the lumbar spine to prolonged full flexion. Clinical Biomechanics, str. 43-46.
- Muslim, K., Bazrgari, B., Hendershot, B., Toosizadeh, N., Nussbaum, M. A., Madigan, M. L. (2013). Disturbance and recovery of trunk mechanical and neuromuscular behaviours following repeated static trunk flexion: Influences of duration and duty cycle on creep-induced effects. Applied ergonomics, str. 643-651.
- O’Sullivan, P., Dankaerts, W., Burnett, A., Chen, D., Booth, R., Carlsen, C., Schultz, A. (2006). Evaluation of the Flexion Relaxation Phenomenon of the Trunk Muscles in Sitting. Spine, str. 2009–2016.
- Petit in Roquelaure. (2015). Low back pain, intervertebral disc and occupational diseases. Int J Occup Saf Ergon, 21(1):15-9.
- Purkart, B. (2019). Manualna terapija, 1. del. Ljubljana: Fizioterapevtski center Barbara Purkart.
- Putz-Anderson, V. (1988). Cumulative Trauma Disorder. Philadelphia: Taylor and Francis Inc., str. 3-8.
- Rogers, E. L., Granata, K. P. (2006). Disturbed paraspinal reflex following prolonged flexion-relaxation and recovery. Spine, str. 839–845.
- Sanchez-Zuriaga, D., Adams, M. A., Dolan, P. Is activation of the back muscles impaired by creep or muscle fatigue? Spine, str. 517–525.
- Sbriccoli, P., Solomonow, M., Zhou, B. H., Baratta, R. V., Lu, Y., Zhu, M. P. in Burger, E. L. (2004). Static load magnitude is a risk factor in the development of cumulative low back disorder. Muscle Nerve 29: 300–308.
- Schleip, R. (2003). Fascial plasticity – a new neurobiological explanation: Part 1. Journal of bodywork and movement therapies, str. 11-19.
- Schleip, R. (2017). Fascia as a sensory organ: clinical applications. Terra rosa e-magazine.
- Shin, G., and G. A. Mirka. (2007). An in vivo assessment of the low back response to prolonged flexion: interplay between active and passive tissues. Clin. Biomech. 22(9):965–971.
- Shin, G., D’Souza, C., Liu, Y. H. (2009). Creep and fatigue development in the low back in static flexion. Spine, str. 1873–1878.
- Simons, D. G., Travel, J. G., Simons, L. S. (1999). Travell and Simons myofascial pain and dysfunction: the trigger point Manual (1. in 2. izdaja). Baltimore: Williams & Wilkins, str. 11-93.
- Solomonow, M. (2009). Ligaments: a source of musculoskeletal disorders. Journal of bodywork and movement therapies, str. 135-154.
- Solomonow, M. (2012). Neuromuscular manifestations of viscoelastic tissue degradation following high and low risk repetitive lumbar flexion. Journal of electromyography and kinesiology, str. 155-175.
- Solomonow, M., Baratta, R. V., Zhou, B. H., Burger, E., Zieske, A., Gedalia, A. (2003a). Muscular dysfunction elicited by creep of lumbar viscoelastic tissue. Journal of electromyography and kinesiology, str. 381-396
- Solomonow, M., Zhou, B. H., Baratta, R. V., Burger, E. (2003b). Biomechanics and electromyography of a cumulative lumbar disorder: response to static flexion. Clinical biomechanics, str. 890-898.
- Solomonow, M., Baratta, R. V., Banks, A., Freudenberger, C. in Zhou, B. H. (2003c). Flexion-relaxation response to static lumbar flexion in males and females. Clinical biomechanics, 18(4), str. 273-279.
- Solomonow, M., Zhou, B. H., Baratta, R. V., Harris, M., (1999). Biomechanics of increased exposure to lumbar injury caused by cyclic loading: part 1. Loss of reflexive muscular stabilization. Spine, str. 2426-2434.
- Solomonow, M., Zhou, B. H., Lu, Y., King, K. B. (2012). Acute repetitive lumbar syndrome: A multi-component insight into the disorder. Journal of bodywork and movement therapies, str. 134-147.
- Toosizadeh, N. Nussbaum, M.A. (2013). Creep deformation of the human trunk in response to prolonged and repetitive flexion: measuring and modelling the effect of external moment and flexion rate. Annals of biomedical engineering, str. 1150-1161.
- Toosizadeh, N., Nussbaum, M. A., Bazrgari, B., Madigan, M. L. (2012). Load-relaxation properties of the human trunk in response to prolonged flexion: measuring and modelling the effect of flexion angle. Plos one.
- Twomey, L., Taylor, J. (1982). Flexion creep deformation and hysteresis in the lumbar vertebral column. Spine, str. 116–122.
- Woo, S. L. Y., Debski, R. E., Zeminski, J., Abramowitch, S. D., Chan Saw, S. S., Fenwick,, J. A. (2000). Injury and repair of ligaments and tendons. Annual review of biomedical engineering, str. 83-118.
- Van der Wal, J. (2009). The architecture of connective tissue in the musculoskeletal system. An often overlooked functional parameter as to proprioception in the locomotor apparatus. International journal of therapeutic massage and bodywork, 2(4), 9–23.